Press-pulse: strategi terapi baru untuk manajemen metabolisme kanker
Nutrisi & Metabolisme 14 , Nomor artikel: 19 ( 2017 )
Abstrak
Latar belakang
Pergeseran dari respirasi ke fermentasi adalah ciri metabolisme sel kanker yang umum. Akibatnya, glukosa dan glutamin menjadi bahan bakar utama untuk mendorong pertumbuhan tumor yang tidak teratur. Terjadinya gangguan “Press-Pulse” secara bersamaan dianggap sebagai mekanisme yang bertanggung jawab atas pengurangan populasi organik selama zaman evolusi sebelumnya. Gangguan pers menghasilkan stres kronis, sedangkan gangguan denyut nadi menghasilkan stres akut pada populasi. Pengurangan populasi terjadi hanya ketika kedua gangguan terjadi bersamaan.
Metode
Konsep umum ini dapat diterapkan pada penatalaksanaan kanker dengan menciptakan tekanan metabolik kronis pada metabolisme energi sel tumor (gangguan tekan) yang digabungkan dengan serangkaian stresor metabolik akut yang membatasi ketersediaan glukosa dan glutamin sementara juga merangsang stres oksidatif spesifik kanker. gangguan nadi). Ketinggian badan keton yang tidak dapat difermentasi melindungi sel normal dari tekanan energi sekaligus meningkatkan tekanan energi pada sel tumor yang tidak memiliki fleksibilitas metabolisme untuk menggunakan keton sebagai sumber energi yang efisien. Kelainan mitokondria dan mutasi genetik membuat sel tumor rentan stres metabolik.
Hasil
Strategi terapi tekan-denyut untuk manajemen kanker diilustrasikan dengan diet ketogenik terbatas kalori (KD-R) yang digunakan bersama dengan obat-obatan dan prosedur yang menciptakan stres akut kronis dan intermiten pada metabolisme energi sel tumor, sambil melindungi dan meningkatkan metabolisme energi normal. sel.
Kesimpulan
Optimalisasi dosis, waktu, dan penjadwalan strategi terapi tekan-pulsa akan memfasilitasi pemberantasan sel tumor dengan toksisitas pasien yang minimal. Strategi terapeutik ini dapat digunakan sebagai kerangka kerja untuk desain uji klinis untuk penatalaksanaan non-toksik pada sebagian besar kanker.
Latar belakang
Menurut ahli paleobiologi, Arens dan West, terjadinya gangguan “Press-Pulse” secara bersamaan dianggap sebagai mekanisme yang bertanggung jawab atas kepunahan populasi organik selama zaman evolusi sebelumnya [ 1]. Gangguan "tekan" dianggap sebagai tekanan lingkungan kronis pada semua organisme dalam komunitas ekologis. Gangguan pers mempromosikan kepunahan melalui hilangnya habitat, berkurangnya reproduksi, dan pembatasan jangkauan dan sumber daya. Gangguan pers akan memaksa komunitas biologis ke dalam keseimbangan baru di mana spesies yang sebelumnya penting menjadi tidak dapat hidup. Gangguan pers akan menggeser lanskap adaptif untuk mendukung spesies terkuat sambil menghilangkan spesies terlemah. Berbeda dengan gangguan pers, gangguan “denyut nadi” dianggap sebagai peristiwa akut yang mengganggu komunitas biologis hingga menghasilkan kematian yang tinggi [ 1]. Melalui kematian yang luas segera setelah peristiwa tersebut, gangguan denyut nadi dapat menyebabkan kepunahan. Namun, kelangsungan hidup beberapa spesies dapat terjadi setelah gangguan nadi, karena lingkungan fisik dan biotik pada akhirnya akan pulih ke kesetimbangan sebelum gangguan [ 1 ]. Hanya ketika pers dan gangguan nadi bertepatan, kepunahan massal spesies, tanpa pemulihan, menjadi mungkin. Kami menjelaskan bagaimana modifikasi konsep tekan-pulsa dapat diadopsi sebagai strategi terapeutik untuk kemungkinan pemberantasan sel tumor. Konsep tekan-pulsa sebaiknya dipertimbangkan mengingat pandangan terkini tentang asal usul kanker.
Asal kanker
Kanker adalah penyakit sistemik yang melibatkan banyak perubahan yang bergantung pada ruang dan waktu dalam status kesehatan sel dan jaringan yang pada akhirnya mengarah pada tumor ganas [ 2 ]. Neoplasia yang melibatkan pertumbuhan sel yang tidak teratur adalah titik akhir biologis dari penyakit ini [ 3 , 4 ]. Invasi sel tumor ke jaringan sekitarnya dan penyebarannya ( metastasis) ke organ jauh merupakan penyebab utama morbiditas dan mortalitas sebagian besar pasien kanker [ 5-9 ] . Data dari American Cancer Society menunjukkan bahwa laju peningkatan kematian akibat kanker/tahun (3,4%) dua kali lipat lebih besar dibandingkan dengan laju peningkatan kasus baru/tahun (1,7%) dari tahun 2013 hingga 2017 [ 10 , 11]. Memang, kanker diprediksi akan mengambil alih penyakit jantung sebagai penyebab utama kematian di masyarakat Barat. Kegagalan untuk secara jelas menentukan asal kanker sebagian besar bertanggung jawab atas kegagalan untuk secara signifikan mengurangi tingkat kematian akibat kanker dari pengobatan dan dalam mengembangkan strategi pencegahan kanker [ 12 ].
Kanker umumnya dianggap sebagai penyakit genetik dimana mutasi somatik acak mendasari asal dan perkembangan penyakit [ 4 , 13-16 ]. Pandangan umum ini sekarang sedang dipertimbangkan kembali secara serius mengingat ketidakkonsistenan utama dengan teori gen [ 2 , 3 , 12 , 14 , 17-24 ] . Bukti yang muncul dari proyek genom kanker menunjukkan bahwa sebagian besar tumor ganas sangat heterogen [ 2 , 15 , 16 , 25-27]. Tingkat heterogenitas ini akan mengacaukan upaya untuk mengeksploitasi cacat genom untuk terapi yang efektif. Selain itu, sebagian besar mutasi genetik dianggap sebagai epifenomena hilir dari metabolisme energi yang tidak teratur [ 2 , 20 , 28 ]. Berbeda dengan heterogenitas genetik yang luas terlihat pada tumor, sebagian besar jika tidak semua sel neoplastik dalam tumor berbagi penyakit metabolisme yang umum dari fermentasi aerobik yang pada akhirnya muncul dari fosforilasi oksidatif yang tidak teratur [ 2 , 17 , 29-33 ] . Mengingat temuan ini, kanker juga dapat dikenali sebagai penyakit metabolik.
Metode
Fermentasi aerobik: penyakit metabolisme sel tumor yang umum
Sebagian besar sel tubuh mengoksidasi glukosa menjadi CO 2 dan air untuk produksi energi. Sebelum memasuki mitokondria untuk oksidasi sempurna, glukosa terlebih dahulu dipecah menjadi dua molekul piruvat melalui jalur glikolitik Embden–Meyerhof–Parnas di sitosol. Karena sebagian besar sel bermandikan oksigen, produksi piruvat terjadi melalui glikolisis aerobik [ 34 ]. Namun, di bawah hipoksia, banyak piruvat direduksi menjadi asam laktat untuk mempertahankan produksi ATP sel. Fermentasi aerobik, di sisi lain, melibatkan produksi asam laktat dalam kondisi normoksik. Karena efek Pasteur akan mengurangi fermentasi asam laktat di bawah normoksia, produksi asam laktat yang terus-menerus dengan adanya oksigen yang cukup merupakan indikasi respirasi abnormal [ 35]. Otto Warburg pertama kali mengusulkan bahwa semua kanker muncul dari kerusakan respirasi seluler. Akibatnya, sel kanker meningkatkan kapasitasnya untuk menghasilkan asam laktat bahkan dengan adanya oksigen untuk mengkompensasi kekurangan respirasi [ 31 , 36 ].
Meskipun hipotesis Warburg tentang asal usul kanker telah menimbulkan kebingungan dan kontroversi [ 37-40 ] , hipotesisnya tidak pernah dibantah. Efek Crabtree dan tingkat konsumsi oksigen yang tinggi yang terlihat pada beberapa sel tumor telah mengacaukan gambaran fosforilasi oksidatif yang rusak pada sel tumor. Efek Crabtree adalah artefak dari lingkungan in vitro dan melibatkan supresi respirasi yang diinduksi glukosa dengan peningkatan produksi asam laktat yang sesuai bahkan di bawah kondisi hiperoksik (pO2 = 120-160 mmHg) yang terkait dengan kultur sel, [ 41 , 42]. Juga, konsumsi oksigen yang terlihat pada sel tumor tidak selalu terkait dengan produksi ATP melalui fosforilasi oksidatif dan karenanya tidak dapat digunakan sendiri sebagai bukti respirasi normal [ 29 , 43-48 ] . Sulit untuk secara akurat mengukur fungsi pernapasan mitokondria dalam sel yang dibiakkan kecuali kontrol yang tepat digunakan, karena lingkungan in vitro dapat mengubah fungsi mitokondria [ 41 , 49 ]. Isu-isu ini telah mengacaukan interpretasi temuan Warburg meskipun upayanya untuk mengklarifikasi isu [ 32 , 48 , 50]. Namun demikian, teori Warburg tentang respirasi aerobik yang tidak mencukupi tetap menjadi penjelasan yang paling dapat dipercaya untuk asal sel tumor [ 2 , 37 , 51-57 ].
Pokok-pokok teori Warburg adalah; 1) respirasi yang tidak mencukupi adalah inisiator predisposisi tumorigenesis dan akhirnya kanker, 2) energi melalui glikolisis secara bertahap mengkompensasi kekurangan energi melalui respirasi, 3) sel kanker terus memproduksi asam laktat dengan adanya oksigen, dan 4) insufisiensi pernapasan akhirnya menjadi tidak dapat diubah. [ 2 , 31 , 32 , 36 , 58 , 59 ]. Warburg menyebut fenomena peningkatan glikolisis dalam sel kanker sebagai "fermentasi aerobik" untuk menyoroti produksi abnormal asam laktat dengan adanya oksigen [ 31 , 32 , 36 , 58, 59 ]. Efraim Racker menciptakan istilah "efek Warburg", yang mengacu pada glikolisis aerobik yang terjadi pada sel kanker [ 60 ]. Meskipun Warburg bersikeras bahwa glikolisis aerobik mengacaukan masalah respirasi yang tidak mencukupi sebagai asal mula kanker [ 31 , 32 ], beberapa bidang metabolisme kanker tetap berpikir bahwa glikolisis aerobik (efek Warburg) adalah masalah sentral dalam metabolisme kanker [ 39 , 61 ]. Warburg dengan jelas mendemonstrasikan bahwa fermentasi aerobik (glikolisis aerobik) adalah efek, dan bukan penyebab, dari kekurangan respirasi [ 36 ]. Oleh karena itu, penargetan bahan bakar yang dapat difermentasi menjadi sangat penting untuk manajemen kanker.
Bukti substansial ada yang menunjukkan bahwa banyak kanker rajin mengkonsumsi glukosa dan menghasilkan asam laktat [ 62-67 ]. Prosedur diagnostik tomografi emisi positron 18 F-deoxyglucose positron (FDG-PET) dianggap sebagai bukti peningkatan penggunaan glukosa oleh beberapa tumor [ 66 ]. Konsumsi glukosa yang meningkat akan diharapkan untuk setiap sel yang bergantung pada glukosa dengan kelainan kuantitatif atau kualitatif di mitokondria, karena peningkatan fermentasi akan diperlukan untuk mengkompensasi kekurangan respirasi [ 43 , 68]. Memang, semua sel tumor yang telah diperiksa hingga saat ini mengandung kelainan pada kandungan atau komposisi kardiolipin, lipid khas dari membran mitokondria bagian dalam yang mengatur fosforilasi oksidatif [ 69-74 ] . Sel mamalia yang mengandung kelainan kardiolipin tidak dapat bernafas secara efektif dan oleh karena itu perlu meningkatkan produksi energi melalui reaksi fermentasi [ 41 , 70 , 73 , 75-78 ]. Fakta ini tidak dapat terlalu ditekankan mengingat argumen bahwa sel tumor dapat memiliki respirasi normal [ 39 , 61 , 79]. Ekspresi kardiolipin yang belum matang terkait dengan aktivitas Kompleks I yang berkurang di membran mitokondria bagian dalam sel tumorigenik dan non-tumorigenik menunjukkan bahwa banyak sel proliferatif yang tumbuh dalam kultur mendapatkan energi melalui fermentasi daripada melalui fosforilasi oksidatif meskipun konsumsi oksigen normal [ 41 , 43 ]. Abnormalitas kardiolipin yang ditemukan pada sel tumor memberikan dukungan langsung untuk teori sentral Warburg. Selain abnormalitas kardiolipin, Pedersen juga menunjukkan bahwa beberapa derajat abnormalitas dapat ditemukan pada jumlah, struktur, atau fungsi mitokondria sel tumor yang memberikan dukungan lebih lanjut untuk teori Warburg [ 68]. Bukti yang mendukung teori asli Warburg berasal dari berbagai jenis kanker dan sekarang sangat banyak [ 2 , 36 , 53 , 80-85 ] . Oleh karena itu, insufisiensi pernapasan, yang timbul dari sejumlah cacat mitokondria, dapat berkontribusi pada metabolisme fermentasi yang terlihat pada sel tumor.
Meskipun metabolisme energi abnormal dan kelainan mitokondria yang terlihat pada kebanyakan kanker dapat muncul sebagian melalui modulasi metabolisme onkogenik [ 4 , 39 , 86 ], data dari percobaan transfer nuklir dan mitokondria menunjukkan bahwa perubahan onkogen adalah efek, bukan penyebab, dari tumorigenesis [ 2 , 14 , 24 , 87 , 88 ]. Mitokondria normal dapat menekan tumorigenesis, sedangkan mitokondria abnormal dapat meningkatkan tumorigenesis [ 14 , 87]. Hasil dari eksperimen ini harus dilihat bersama, karena hasil dari eksperimen tunggal mana pun tidak mampu menjungkirbalikkan teori gen [ 14 ]. Kemajuan terbaru dalam teknologi CRISPR/Cas9 dapat membantu menghasilkan nuklei dengan perubahan pada gen terkait tumor spesifik untuk mengevaluasi lebih lanjut pengaruh mutasi gen dan fungsi mitokondria pada tumorigenesis. Akuisisi mitokondria disfungsional dalam makrofag melalui hibridisasi fusi dengan sel tumor non-metastatik memberikan argumen yang kuat untuk asal sel kanker yang menjadi metastatik [ 5 , 89-91]. Kami baru-baru ini menunjukkan bagaimana semua tanda kanker Hanahan & Weinberg, termasuk mutasi genomik, dapat dikaitkan baik secara langsung maupun tidak langsung dengan disfungsi mitokondria [ 2 , 56 , 92 ].
Fermentasi asam amino juga bisa mendorong metabolisme kanker
Sebagai hasil dari respirasi aerobik yang tidak mencukupi, sel kanker harus bergantung terutama pada metabolisme fermentasi untuk menjaga keseimbangan energi dan kelangsungan hidup. Selain fosforilasi tingkat substrat dalam sitoplasma melalui fermentasi asam laktat, fosforilasi tingkat substrat siklus TCA juga dapat menghasilkan ATP dalam jumlah yang signifikan [ 93-98 ] . Selain glukosa, sel kanker juga sangat bergantung pada glutamin untuk pertumbuhan dan kelangsungan hidup [ 99 – 102]. Glutamin bersifat anapleurotik dan dapat dengan cepat dimetabolisme menjadi glutamat dan kemudian menjadi α-ketoglutarat untuk masuk ke dalam siklus TCA. Selain berfungsi sebagai sumber karbon/nitrogen untuk pertumbuhan sel tumor, glutamin juga berperan dalam kelangsungan hidup dan pertumbuhan sel kanker melalui pelepasan amonia secara enzimatik ke lingkungan mikro [ 103 ]. Reaksi thiokinase suksinat siklus TCA dapat menghasilkan sebagian besar ATP seluler melalui fosforilasi tingkat substrat di bawah hipoksia atau dalam sel tumor dengan fosforilasi oksidatif yang rusak [ 78]. Produksi ATP mitokondria melalui fosforilasi tingkat substrat siklus TCA, menggunakan glutamin sebagai substrat, dapat memberikan kesan bahwa metabolisme energi mitokondria normal pada beberapa sel kanker terutama dalam kombinasi dengan konsumsi oksigen dan produksi CO2 . Meskipun Warburg tidak membahas peran fosforilasi tingkat substrat siklus TCA dalam karya aslinya [ 31 , 36 ], peningkatan fosforilasi tingkat substrat siklus TCA akan diharapkan dalam sel dengan defisiensi OxPhos, seperti fermentasi asam laktat diharapkan dalam sel dengan kekurangan ini. Studi lebih lanjut akan diperlukan untuk membuktikan peran fermentasi glutamin dalam sel kanker.
Glukosa dan glutamin bekerja secara sinergis untuk mendorong pertumbuhan sel tumor yang cepat. Metabolisme glutamin dapat menghasilkan ATP dari siklus TCA dalam kondisi aerobik. Glutamin juga merupakan donor nitrogen untuk biosintesis nukleotida dan dapat berfungsi sebagai prekursor untuk sintesis lipid dalam kondisi hipoksia [ 104 , 105 ]. Kami juga menemukan bahwa hanya sejumlah kecil glutamin yang dimetabolisme menjadi asam laktat di bawah normoksia atau hipoksia pada sel glioblastoma invasif VM-M3 yang konsisten dengan temuan pada sel tumor lainnya [ 105 – 107]. Kami menyarankan bahwa metabolisme glukosa dan glutamin untuk energi akan bergantung pada keadaan fisiologis lingkungan mikro tumor, dan akan lebih penting pada tumor dengan fenotipe Warburg yang agresif. Kami menemukan bahwa penargetan glutamin dapat efektif dalam mengelola kanker metastatik sistemik pada tikus VM/Dk [ 108 ].
Fermentasi asam amino dapat menghasilkan energi melalui fosforilasi tingkat substrat siklus TCA dalam kondisi hipoksia [ 94 , 96 , 97 , 109 , 110 ]. Suksinat adalah produk limbah fermentasi asam amino yang dapat meningkatkan peradangan serta menghambat keluarga hidroksilase prolyl, yang memfasilitasi degradasi Hif-1α melalui produk gen von Hippel-Lindau (VHL) [ 111-113 ] . Melalui aksinya pada beberapa jalur glikolitik, stabilisasi Hif-1α meningkatkan fermentasi aerobik [ 114 – 116]. Ini bisa sulit untuk menentukan, bagaimanapun, sejauh mana produksi ATP mitokondria dalam sel tumor muncul dari respirasi digabungkan atau dari fosforilasi tingkat substrat siklus TCA [ 94 , 98 ].
Beberapa produk sampingan dari fermentasi asam amino juga dapat terakumulasi dalam lingkungan mikro tumor termasuk asetat, glutamat, alanin, suksinat, dan amonia. Meskipun asetat telah dianggap sebagai bahan bakar potensial untuk mendukung pertumbuhan sel tumor [ 117 , 118 ], kadar asetat umumnya rendah dalam sirkulasi [ 119 ]. Jaworski et al. baru-baru ini memberikan diskusi komprehensif tentang potensi peran asetat dalam metabolisme tumor [ 120]. Harus diakui bahwa dengan pengecualian glukosa dan glutamin, tidak ada bahan bakar potensial lain yang diperlukan untuk fermentasi sel tumor yang mungkin tersedia dalam jumlah yang cukup untuk mendorong pertumbuhan sel tumor yang kuat. Karena banyak asam amino yang disintesis dari glukosa dan glutamin, penargetan glukosa dan glutamin akan menghilangkan lingkungan mikro dari bahan bakar yang dapat difermentasi. Oleh karena itu, pembatasan glukosa dan glutamin menjadi sangat penting untuk menargetkan pertumbuhan dan kelangsungan hidup sel tumor. Peran glukosa dan glutamin dalam mendorong metabolisme energi sel tumor ditunjukkan pada Gambar 1 .
Menargetkan Glukosa dan Glutamin untuk Manajemen Metabolik Kanker. Sel kanker sangat bergantung pada glukosa dan glutamin untuk bertahan hidup dan tumbuh. Energi melalui metabolisme fermentasi (fosforilasi tingkat substrat, SLP) dalam glikolisis dan siklus asam trikarboksilat (TCA) akan mengkompensasi penurunan energi melalui fosforilasi oksidatif (OxPhos) yang terjadi pada sel tumor. Oval kuning menunjukkan tiga sumber produksi ATP seluler. Karbon glukosa dapat digunakan untuk jalur glikolitik dan pentosa fosfat (PPP) untuk memasok ATP dan prekursor untuk sintesis lipid dan nukleotida, serta untuk produksi glutathione. Glutamin menyediakan nitrogen amida untuk sintesis amonia dan nukleotida. Glutamat yang diturunkan dari glutamin menyediakan karbon anapleurotik ke siklus TCA melalui α-KG untuk sintesis protein sambil juga menyediakan ATP melalui SLP siklus TCA. Fosforilasi tingkat substrat siklus TCA melalui reaksi thiokinase suksinat dapat menghasilkan ATP seluler yang signifikan di bawah hipoksia terutama pada sel tumor dengan respirasi yang rusak.78]. Glutamat yang diturunkan dari glutamin juga digunakan untuk produksi glutathione yang melindungi sel tumor dari stres oksidatif. Penargetan glukosa dan glutamin dengan demikian akan membuat sel kanker rentan terhadap terapi stres oksidatif. Penargetan simultan glukosa dan glutamin melalui strategi terapi tekan-pulsa akan membuat sel tumor kelaparan produksi energi sambil memblokir kemampuannya untuk mensintesis protein, lipid, dan nukleotida. Glukosa dan glutamin juga dapat dihasilkan secara internal melalui pencernaan lisosom dari glikokonjugat fagositosis dan protein (lihat teks). Peningkatan badan keton yang tidak dapat difermentasi melalui, pembatasan kalori, diet ketogenik, atau suplementasi akan memberi sel normal sumber energi alternatif selain glukosa sekaligus melindunginya dari stres oksidatif.67 , 282 , 283 ]
Metabolit energi sel tumor dari kanibalisme dan fagositosis
Bukti yang muncul menunjukkan bahwa makrofag, atau hibridisasi fusinya dengan sel punca neoplastik, adalah asal dari sel kanker metastatik [ 5 , 89 , 121-124 ]. Terapi radiasi dapat meningkatkan hibridisasi fusi yang dapat meningkatkan risiko sel tumor invasif dan metastatik [ 91 , 125 ]. Kanibalisme dan fagositosis puing-puing seluler adalah karakteristik makrofag dan sel kanker myeloid yang terkenal dengan sifat makrofag [ 121 , 126 – 131]. Shelton menunjukkan bahwa sel glioblastoma dengan sifat myeloid dapat bertahan di Matrigel (materi matriks ekstraselular) tanpa tambahan glukosa dan glutamin [ 132 ]. Akumulasi laktat secara bertahap di media menunjukkan bahwa sel glioblastoma bertahan melalui pencernaan lisosom dan fermentasi aerobik glikokonjugat yang ada di Matrigel. Kematian sel glioblastoma terjadi segera setelah penambahan klorokuin, yang menetralkan keasaman lisosom dan pencernaan [ 132 ]. Temuan Shelton konsisten dengan temuan yang lebih baru dari Kamphorst et al. dalam menunjukkan bahwa sel-sel adenokarsinoma duktus pankreas dapat memperoleh glutamin dalam kondisi nutrisi yang buruk melalui pencernaan lisosom protein ekstraseluler [ 133]. Oleh karena itu, perlu juga menargetkan pencernaan lisosom, di bawah kondisi glukosa dan glutamin yang berkurang, untuk secara efektif mengelola kanker invasif dan metastatik yang mengekspresikan kanibalisme dan fagositosis.
Integritas genom dan metabolisme energi
Bukti yang muncul menunjukkan bahwa fungsi enzim perbaikan DNA dan integritas genom inti sangat tergantung pada energi yang berasal dari respirasi normal [ 134-142 ] . Studi sebelumnya pada sel ragi dan mamalia menunjukkan bahwa gangguan respirasi aerobik dapat menyebabkan mutasi (kehilangan heterozigositas, ketidakstabilan kromosom, dan modifikasi epigenetik, dll.) pada genom inti [28 , 141 , 143 , 144 ] . Ketergantungan yang berlarut-larut pada fermentasi menyebabkan stres oksidatif yang mengarah pada produksi spesies oksigen reaktif (ROS) sebagian besar melalui koenzim Q pasangan mitokondria [ 145]. Selain perannya dalam pensinyalan onkogenik, kelebihan produksi ROS merusak fungsi mitokondria, dan dapat bersifat karsinogenik dan mutagenik [ 146 , 147 ]. Mutasi somatik dan ketidakstabilan genom yang terlihat pada sel tumor muncul dari ketergantungan yang berlarut-larut pada metabolisme energi fermentasi dan gangguan keseimbangan redoks melalui stres oksidatif berlebih.
Kami baru-baru ini membahas bagaimana transisi dari respirasi ke fermentasi dapat menjelaskan “Paradoks Onkogenik” Szent-Gyorgi, yaitu proses di mana berbagai agen provokatif (radiasi, peradangan, hipoksia, bahan kimia karsinogenik, usia, mutasi germline, dll.) dapat menghasilkan kanker melalui mekanisme patologis umum [ 2 , 148 ]. Mukherjee dan Cairns juga berjuang untuk menjelaskan paradoks onkogenik [ 149 , 150]. Semua agen penyebab kanker yang provokatif ini merusak pernapasan sehingga memaksa sel untuk lebih mengandalkan energi yang dihasilkan melalui fermentasi untuk bertahan hidup. Menurut teori metabolisme mitokondria kanker, heterogenitas genom besar terlihat pada sel tumor muncul sebagai konsekuensi, bukan sebagai penyebab, disfungsi mitokondria [ 2 , 14 , 28 ]. Oleh karena itu, strategi terapeutik yang menargetkan kelainan metabolisme yang umum pada sebagian besar sel tumor harus lebih efektif dalam mengelola kanker daripada strategi yang menargetkan mutasi genetik yang sangat bervariasi antara tumor dengan tingkat histologis yang sama dan bahkan di dalam tumor yang sama.
Evolusi manusia dan keserbagunaan adaptif
Rick Potts, ahli paleoantropologi di Smithsonian Institution, menyatakan bahwa keberhasilan evolusi spesies kita sebagian besar disebabkan oleh pewarisan germline dari sifat-sifat yang memberikan keserbagunaan adaptif [ 151-153 ] . Adaptasi didefinisikan dalam hal, 1) kemampuan suatu organisme untuk bertahan melalui perubahan lingkungan yang besar, 2) untuk menyebar ke habitat baru, dan 3) untuk merespon dengan cara baru terhadap lingkungannya [ 153]. Karakteristik ini diasah selama jutaan tahun dan memungkinkan manusia beradaptasi dengan cepat terhadap perubahan mendadak dalam lingkungan fisik termasuk perubahan kelembapan, suhu, sumber makanan, dll. Kemampuan beradaptasi terhadap perubahan lingkungan yang mendadak adalah sifat genom, yang dipilih secara berurutan untuk memastikan kelangsungan hidup di bawah ekstrem lingkungan [ 65 , 154 ].
Hipotesis Potts merupakan perluasan dari teori asli Darwin (Bab IV, Seleksi Alam) dan dapat diterapkan pada sel-sel individu organisme, yang ada sebagai masyarakat sel yang terintegrasi [ 65 , 154 ]. Oleh karena itu, keberhasilan dalam mengatasi tekanan lingkungan dan penyakit bergantung pada tindakan terpadu dari semua sel dalam organisme. Selanjutnya, tindakan terpadu ini bergantung pada fleksibilitas genom setiap sel, yang merespons sinyal internal dan eksternal sesuai dengan kebutuhan organisme. Lebih khusus lagi, hanya sel-sel yang memiliki fleksibilitas dalam pemanfaatan nutrisi yang akan mampu bertahan di bawah tekanan nutrisi. Oleh karena itu pemaksaan lingkungan telah memilih genom yang paling mampu beradaptasi terhadap perubahan untuk mempertahankan homeostasis metabolik.65 , 152 , 153 , 155 ]. Konsep ini pertama kali dibahas dalam kaitannya dengan pengelolaan kanker otak [ 65 ].
Gagasan yang dipegang secara luas bahwa sel-sel tumor memiliki keunggulan pertumbuhan dan lebih bugar daripada sel-sel normal bertentangan dengan teori evolusi Darwin dan juga teori fleksibilitas adaptif Potts [65 , 153 , 154 ] . Sulit membayangkan bagaimana akumulasi acak dari mutasi somatik dapat meningkatkan kemampuan beradaptasi dan kebugaran sel kanker. Penting untuk diketahui bahwa mutasi pada p53 , K-Ras , dan Raf berdampak negatif pada efisiensi energi mitokondria sehingga membuat sel dengan mutasi ini kurang fleksibel secara metabolik daripada sel normal [ 28 , 44 , 53 , 135 , 156– 159 ]. Memang mengaktifkan mutasi pada mitokondria target K-Ras , sehingga meningkatkan glikolisis [ 53 , 160 ]. Glikolisis yang ditingkatkan akan membuat sel tumor tampak lebih sehat secara metabolik daripada sel normal di lingkungan hipoksia [ 161 , 162 ]. Sebagian besar sel normal, bagaimanapun, tidak dapat tumbuh dalam kondisi hipoksia dan akan sering mati dalam lingkungan hipoksia akibat gagal napas. Sel tumor lebih cocok daripada sel normal untuk bertahan hidup di relung hipoksia dari lingkungan mikro tumor. Adaptasi hipoksia sel tumor memungkinkan mereka untuk menghindari apoptosis karena pemrograman ulang metaboliknya setelah hilangnya fungsi pernapasan secara bertahap [ 31 , 32 , 162, 163 ]. Tingginya tingkat glikolisis sel tumor dan glutaminolisis juga akan membuat mereka resisten terhadap obat apoptosis, ROS, dan kemoterapi [ 163 ]. Meskipun memiliki kadar ROS yang tinggi, glutamat yang berasal dari glutamin berkontribusi pada produksi glutathione yang dapat melindungi sel tumor dari ROS [ 164 ]. Selama sel-sel tumor memiliki akses ke bahan bakar metabolik yang dibutuhkan untuk glikolisis dan fosforilasi tingkat substrat siklus TCA (glukosa dan glutamin, masing-masing), mereka akan tampak memiliki keunggulan pertumbuhan dibandingkan kebanyakan sel normal .]. Menurut Darwin dan Potts, mutasi yang memberikan keunggulan selektif adalah mutasi yang akan meningkatkan kelangsungan hidup di bawah tekanan lingkungan. Jika beberapa mutasi titik patogenik, penataan ulang kromosom, dan kelainan mitokondria memberikan keuntungan kebugaran atau kelangsungan hidup sel tumor, maka kelangsungan hidup di bawah tekanan lingkungan dan kekurangan gizi harus lebih baik dalam sel tumor daripada sel normal [165 ] . Namun, ini bukanlah yang sebenarnya terjadi ketika hipotesis diuji.
Misalnya, ketika tikus atau orang dengan tumor ditempatkan di bawah tekanan energi menggunakan diet pengurangan energi (pembatasan glukosa), banyak sel tumor mati sementara sel normal bertahan hidup. Memang, kesehatan dan vitalitas sel-sel normal meningkat dengan waktu di bawah pengurangan energi diet sementara sel tumor hiper-glikolitik mengalami krisis energi yang memicu kematian apoptosis [ 166 , 167 ]. Pendukung pendapat ini berasal dari penelitian pengobatan tumor otak dengan stres energi makanan [ 114 , 168 – 174]. Jelas bahwa kemampuan beradaptasi terhadap tekanan lingkungan lebih besar pada sel normal daripada sel tumor, karena sel normal dapat beralih dari metabolisme glukosa ke metabolisme badan keton ketika glukosa menjadi terbatas. Fosforilasi oksidatif mitokondria kurang kuat dalam sel tumor daripada sel normal sementara pemanfaatan glukosa melalui fermentasi asam laktat lebih besar pada sel tumor daripada sel normal. Oleh karena itu, menargetkan ketersediaan glukosa akan menyebabkan kematian yang lebih besar pada sel tumor daripada pada sel normal. Cacat rantai pernapasan mitokondria akan mencegah sel tumor menggunakan badan keton untuk energi [ 145]. Akibatnya, sel tumor yang bergantung pada glikolisis kurang dapat beradaptasi dengan stres metabolik daripada sel normal. Kerentanan ini dapat dimanfaatkan untuk menargetkan metabolisme energi sel tumor [ 160 , 163 ].
Hal ini juga memungkinkan bahwa stres energi terapeutik dapat memulihkan lingkungan mikro sehingga membalikkan metabolisme energi abnormal dan perilaku pertumbuhan sel tumor yang tidak mengandung mutasi genetik [ 19 , 175 ]. Berbeda dengan pengurangan energi makanan, radiasi dan obat-obatan beracun dapat merusak lingkungan mikro dan mengubah sel normal menjadi sel tumor sekaligus menciptakan sel tumor yang menjadi sangat resisten terhadap obat dan radiasi. Sel-sel tumor yang resistan terhadap obat muncul sebagian besar dari kerusakan pernapasan pada sel-sel pra-kanker pengamat. Sel-sel ini sering kali menjadi sangat bergantung pada fermentasi untuk energi.
Adaptasi sel normal yang lebih besar daripada sel tumor terhadap tekanan energi diperkirakan berdasarkan teori Darwin dan Potts [ 154 ]. Fleksibilitas metabolik memungkinkan organisme untuk merespons secara terkoordinasi terhadap tekanan lingkungan dan ketersediaan substrat yang terbatas. Stres energi akan memaksa semua sel normal bekerja sama untuk kelangsungan hidup organisme [ 154 ]. Mutasi patogen dan ketidakstabilan genom akan mengurangi kemampuan beradaptasi dan fleksibilitas metabolisme di bawah tekanan energi. Semakin besar ketidakstabilan genom dalam sel tumor, semakin sedikit kemampuan beradaptasi mereka terhadap stres. Konsep ini mirip dengan konsep Nowell kecuali dalam melihat ketidakstabilan genomik sebagai sebuah kewajiban daripada sebagai keuntungan untuk perkembangan [ 154 , 176]. Karena energi yang dihasilkan melalui fosforilasi tingkat substrat lebih besar pada sel tumor daripada sel normal, sel tumor lebih tergantung daripada sel normal pada ketersediaan bahan bakar yang dapat difermentasi (glukosa dan glutamin) [ 94 ]. Dengan sedikit pengecualian, sebagian besar sel normal mengubah metabolisme energi dari glukosa menjadi badan keton dan lemak ketika ditempatkan di bawah tekanan energi akibat kekurangan glukosa, defisiensi insulin, dan puasa berkepanjangan. Pergeseran ini adalah hasil dari keserbagunaan adaptif dan stabilitas genomik, yang kurang pada sel tumor tetapi menonjol pada sel dan jaringan dengan fungsi mitokondria yang kuat.
Sel-sel tumor akan mengalami kesulitan untuk bertahan hidup dan tumbuh, terlepas dari komplemen perubahan genomiknya, jika bahan bakar yang dapat difermentasi dibatasi dalam lingkungan mikro. Badan keton dan lemak adalah bahan bakar yang tidak dapat difermentasi [ 177 ]. Sel tumor mengalami kesulitan menggunakan badan keton dan lemak sebagai bahan bakar ketika glukosa berkurang [ 57 , 178 – 180 ]. Meskipun beberapa sel tumor mungkin tampak mengoksidasi badan keton dengan adanya enzim ketolitik [ 181], tidak jelas apakah badan keton dan lemak dapat memberikan energi yang cukup untuk kelangsungan hidup sel tanpa adanya glukosa dan glutamin. Studi pada tikus syngeneic immunocompetent dan xenografts dengan tumor otak adalah bukti konsep bahwa sel tumor kurang beradaptasi dibandingkan sel normal ketika ditempatkan di bawah tekanan energi [ 114 , 170 , 171 , 182-184 ] . Apoptosis di bawah tekanan energi lebih besar pada sel tumor daripada sel normal [ 170]. Cacat genetik ganda pada sel tumor akan mengurangi fleksibilitas genom sehingga meningkatkan kemungkinan kematian sel di bawah tekanan lingkungan yang akan menurunkan glukosa dan meningkatkan badan keton. Terlepas dari kapan atau bagaimana cacat genom terlibat dalam inisiasi atau perkembangan tumor, cacat ini dapat dimanfaatkan untuk manajemen tumor atau resolusi [ 12 ].
Hasil
Press-pulse: strategi terapeutik untuk menghilangkan sel kanker secara bertahap
Mark Vincent menyarankan bagaimana strategi Press-Pulse dapat digunakan untuk menargetkan sel tumor [ 185 ]. Kami sekarang telah memperluas konsep ini untuk menunjukkan bagaimana strategi terapi tekan-denyut dapat digunakan untuk manajemen non-toksik dan kemungkinan penyelesaian kanker. Diet ketogenik yang dibatasi kalori atau pengurangan energi diet menciptakan stres metabolik kronis dalam tubuh. Stres energi ini bertindak sebagai gangguan pers; efek yang akan lebih besar pada sel tumor daripada sel normal karena ketergantungannya pada metabolisme energi fermentasi, mitogen, pensinyalan anabolik (IGF-1, mTOR, dll.), peningkatan stres redoks, dan beban mutasi. Obat yang menargetkan ketersediaan glukosa dan glutamin akan bertindak sebagai gangguan denyut nadi yang menyebabkan pengurangan akut bahan bakar yang bergantung pada tumor ini [ 186]. Terapi oksigen hiperbarik juga dapat dianggap sebagai gangguan nadi lain dalam mengangkat ROS ke tingkat yang lebih tinggi pada sel tumor daripada sel normal, sehingga mendorong kematian sel kanker melalui stres redoks [ 40 ]. Sel normal siap bertransisi ke metabolisme tubuh keton untuk perlindungan terhadap kerusakan ROS dan stres oksidatif. Oleh karena itu tujuannya adalah untuk menghasilkan strategi terapeutik yang dapat mengelola kanker secara lebih efektif daripada terapi kanker toksik yang saat ini digunakan di sebagian besar standar perawatan. Contoh berikut mengilustrasikan potensi strategi terapi tekan-denyut untuk manajemen kanker.
Pembatasan kalori dan diet Ketogenik terbatas: gangguan pers
Pembatasan kalori, puasa hanya air, dan diet ketogenik terbatas mengurangi kadar glukosa dan insulin yang bersirkulasi sambil meningkatkan kadar badan keton yang bersirkulasi. Diet ketogenik (KD) adalah diet rendah karbohidrat-tinggi lemak yang banyak digunakan untuk mengurangi serangan epilepsi refrakter pada anak-anak [ 187 , 188 ]. KD dapat lebih efektif mengurangi glukosa dan meningkatkan badan keton darah daripada CR sendiri membuat KD berpotensi lebih terapeutik melawan tumor daripada CR [ 174 , 189 , 190]. Komposisi protein dan lemak KD berbeda dari diet tipe Atkins karena memiliki protein yang relatif lebih sedikit dan lebih banyak lemak daripada diet Atkins. Hal ini penting karena beberapa asam amino yang ditemukan dalam protein dapat dideaminasi menjadi piruvat, yang kemudian dapat dimetabolisme untuk membentuk glukosa melalui glukoneogenesis [ 191 ]. Campbell menunjukkan bahwa pertumbuhan tumor pada tikus lebih besar di bawah protein tinggi (>20%) daripada di bawah kandungan protein rendah (<10%) dalam diet [ 192]. Asam amino protein dapat dimetabolisme menjadi glukosa melalui siklus Cori. Lemak dalam KD yang digunakan secara klinis juga mengandung lebih banyak trigliserida rantai menengah daripada diet Atkins. Akibatnya, kadar glukosa darah akan lebih rendah dan kadar keton tubuh akan lebih tinggi dengan KD dibandingkan dengan diet tipe Atkins. Pembatasan kalori, puasa, dan KD yang dibatasi bersifat anti-angiogenik, anti-inflamasi, dan pro-apoptosis sehingga dapat menargetkan dan menghilangkan sel tumor melalui berbagai mekanisme [ 114 , 166 , 171 , 174 , 182 , 193 , 194]. Diet ketogenik juga dapat menghemat protein otot, meningkatkan kekebalan , dan menunda kaheksia kanker , yang merupakan masalah utama dalam pengelolaan kanker metastatik [ 195-198 ].
Efek terapeutik KD yang digunakan sendiri atau dalam kombinasi dengan terapi lain telah didokumentasikan dalam studi praklinis untuk beberapa model kanker termasuk neuroblastoma [ 199 , 200 ], kanker paru-paru [ 201 ], kanker prostat [ 202 , 203 ], kanker payudara dan ovarium [ 204 , 205 ], kanker kepala & leher [ 204 ], kanker usus besar [ 206 ], dan kanker pankreas [ 198 ]. Studi praklinis ini juga memotivasi laporan kasus dan studi percontohan pada manusia dengan kanker otak dan kanker lainnya [ 169 , 181 , 207 – 214]. Jelas dari penelitian ini dan penelitian lain pada anak-anak dan orang dewasa dengan kanker bahwa KD umumnya aman dan dapat ditoleransi dengan baik [ 168, 212, 213, 215-217 ] , Pengamatan ini juga konsisten dengan penelitian puluhan tahun yang diperoleh dari evaluasi anak-anak yang dirawat . dengan KD untuk manajemen epilepsi [ 218 ]. Informasi tentang diet ketogenik dapat diperoleh dari situs web Charlie Foundation ( https://www.charliefoundation.org ).
Kami baru-baru ini mengembangkan Kalkulator Indeks Glukosa/Keton (GKIC) untuk menilai efek terapeutik potensial dari berbagai karbohidrat rendah dan KD untuk manajemen kanker otak [ 189 ]. GKIC adalah alat sederhana yang mengukur rasio glukosa darah terhadap keton darah dan dapat membantu memantau kemanjuran terapi metabolik pada model hewan praklinis dan uji klinis untuk kanker otak ganas atau untuk kanker apa pun yang menunjukkan fermentasi aerobik. Nilai GKI 1,0 atau lebih rendah dianggap terapeutik, meskipun manfaat terapeutik tampaknya lebih terkait dengan peningkatan badan keton dan penekanan insulin dibandingkan dengan penurunan glukosa [ 190 , 215]. Namun, peningkatan kadar keton tubuh umumnya lebih besar saat kadar glukosa darah lebih rendah daripada saat kadar glukosa lebih tinggi [ 174 , 219 , 220 ]. Oleh karena itu GKI dapat berfungsi sebagai biomarker untuk menilai kemanjuran terapeutik dari berbagai diet dalam berbagai jenis kanker.
Ketersediaan glukosa yang berkurang dan penekanan pensinyalan insulin akan menghasilkan tekanan energi kronis pada sel-sel tumor yang terutama bergantung pada glukosa untuk pertumbuhan dan kelangsungan hidup. Penting untuk diingat bahwa insulin menggerakkan glikolisis melalui stimulasi kompleks piruvat dehidrogenase [ 221 , 222 ]. Penurunan kadar glukosa juga akan mengurangi substrat untuk jalur glikolitik dan pentosa fosfat sehingga mengurangi energi seluler, dan sintesis prekursor glutathione dan nukleotida (Gbr. 1 ) .
Badan keton yang larut dalam air ( D -β-hidroksibutirat dan asetoasetat) diproduksi sebagian besar di hati dari asam lemak turunan adiposit dan lemak diet ketogenik. Badan keton memotong glikolisis dan langsung memasuki mitokondria untuk metabolisme menjadi asetil-KoA [ 223 ]. Berbeda dengan metabolisme asam lemak, yang menghasilkan NADH dan FADH 2 , metabolisme tubuh keton hanya menghasilkan NADH [ 145 ]. Selain itu, metabolisme tubuh keton tidak menginduksi uncoupling mitokondria berbeda dengan metabolisme asam lemak jenuh [ 145 ]. Metabolisme D-β-hidroksibutirat dalam sel normal karenanya akan meningkatkan rentang redoks antara Kompleks I dan III, sehingga meningkatkan delta G' dari hidrolisis ATP sementara, pada saat yang sama, mengurangi pembentukan ROS melalui koenzim Kompleks II pasangan Q [ 224 , 225 ] . Karena cacat mitokondria, sel tumor tidak dapat mengeksploitasi manfaat terapeutik dari pembakaran badan keton seperti yang dilakukan sel normal. Memang, campuran rasemat dari badan D-/L-keton dapat menjadi racun bagi sel tumor di bawah kondisi glukosa rendah dan tinggi [ 57 , 190 ]. Baik dkk. menemukan bahwa uncoupling protein 2 diekspresikan secara berlebihan pada sel tumor, tetapi tidak pada sel kontrol normal [ 226]. Temuan ini memberikan mekanisme molekuler yang masuk akal dimana badan keton menyelamatkan sel normal tetapi menekan pertumbuhan garis kanker.
Berbeda dengan D-β-hidroksibutirat, L-β-hidroksibutirat adalah beta-teroksidasi sehingga menghasilkan NADH dan FADH 2 . FADH 2 akan mengirimkan elektron ke Kompleks III, yang dapat meningkatkan semikuinon dari Q, bentuk setengah tereduksi. Q semiquinone akan bereaksi dengan molekul oksigen untuk membentuk superoksida O 2 .- radikal bebas [ 145 ]. Ketosis terapeutik dengan rasemat keton ester juga dapat membuatnya layak untuk mempertahankan hipoglikemia dengan aman untuk menginduksi stres metabolik pada sel kanker [ 227 ]. Oleh karena itu, campuran ester L- dan D-keton memiliki potensi untuk meningkatkan stres oksidatif pada sel tumor sekaligus mengurangi stres oksidatif pada sel normal, masing-masing [ 145 , 228]. Ada juga bukti yang menunjukkan bahwa badan keton dapat menghambat histone deacetylases (HDAC) [ 229 ]. Inhibitor HDAC berperan dalam penargetan epigenom kanker [ 230 ]. Peradangan deregulasi juga dianggap sebagai salah satu ciri khas kanker. Ketosis terapeutik mengurangi penanda inflamasi yang bersirkulasi, dan keton secara langsung menghambat inflamasiom NLRP3, jalur proinflamasi penting yang terkait dengan karsinogenesis dan target penting untuk respons pengobatan kanker [ 231 ]. Tidak ada efek samping yang merugikan dari ketosis terapeutik jangka pendek, tetapi efek samping yang relatif ringan telah dicatat pada beberapa anak dengan epilepsi setelah penggunaan diet ketogenik jangka panjang termasuk sembelit, batu ginjal, ketidakseimbangan elektrolit, dan patah tulang.218 ]. Efek merugikan ini dengan mudah dikelola dengan berbagai suplemen dan pucat dibandingkan dengan efek merugikan yang dihasilkan dari standar perawatan saat ini [ 232 ]. Secara umum, saat ini tidak ada obat kanker yang dikenal yang mewujudkan sifat terapeutik dari badan keton.
Pengurangan stres psikologis: gangguan pers
Stres psikologis kronis diketahui memicu tumorigenesis melalui peningkatan glukosa darah, glukokortikoid, katekolamin, dan faktor pertumbuhan seperti insulin (IGF-1) [ 233 , 234 ]. Selain diet ketogenik yang dibatasi kalori, manajemen stres psikologis yang melibatkan olahraga, yoga, musik, dll. Juga bertindak sebagai gangguan pers yang dapat membantu mengurangi kelelahan, depresi, dan kecemasan pada pasien kanker dan model hewan [235 – 238 ] . Suplementasi keton juga terbukti mengurangi perilaku kecemasan pada model hewan [ 239 ]. Mekanisme kerja manajemen stres psikologis untuk pengendalian kanker sebagian besar akan melibatkan penurunan kadar glukosa darah yang berkontribusi terhadap pertumbuhan tumor.
Diet ketogenik terbatas digunakan dengan 2-Deoxyglucose
Pembatasan kalori atau puasa terapeutik adalah anti-angiogenik, anti-inflamasi, dan pro-apoptosis, dan dengan demikian menargetkan berbagai tanda kanker [ 114 , 166 , 167 , 170 , 171 , 182 , 240 – 243 ]. Keadaan fisiologis ini juga meningkatkan kemanjuran kemoterapi dan terapi radiasi, sekaligus mengurangi efek samping [ 244 – 246]. Memang, obat kemoterapi dosis rendah dapat digunakan bila diberikan bersamaan dengan pembatasan kalori atau diet ketogenik terbatas (KD-R). Kami menunjukkan interaksi sinergis antara KD-R dan inhibitor glikolisis 2-deoxyglucose (2-DG) untuk pengelolaan metabolik glioma tikus ganas CT-2A syngeneic [ 247]. Sangat menarik untuk menemukan bahwa 2-DG (25 mg/kg) tidak memiliki efek terapeutik pada pertumbuhan tumor CT-2A ketika diberikan sendiri pada tikus dengan diet karbohidrat tinggi standar, tetapi memiliki efek terapeutik yang kuat ketika diberikan dengan KD-R . Memang, dosis 2-DG yang relatif rendah ini menjadi agak beracun ketika digunakan dengan KD menunjukkan bahwa dosis yang lebih rendah dari beberapa obat penargetan tumor juga bisa efektif bila diberikan dengan KD-R. Selain 2-DG, serangkaian inhibitor glikolisis lainnya mungkin juga menghasilkan efek terapeutik yang serupa bila digabungkan dengan KD-R termasuk 3-bromopiruvat, oksaloasetat, dan lonidamin [ 58 , 186 , 248 – 250]. Dalam contoh di sini KD-R adalah tekanan yang membuat sel-sel kanker secara selektif rentan terhadap kematian dan 2-DG adalah denyut nadi, yang dapat digunakan sesekali atau didaur ulang untuk menghindari toksisitas.
Diet ketogenik digunakan dengan terapi radiasi
Adrienne Scheck dan rekannya menunjukkan bahwa kemanjuran terapeutik radioterapi melawan glioma tikus GL261 yang ditumbuhkan secara ortotopik dapat sangat ditingkatkan bila dikombinasikan dengan diet ketogenik yang tersedia secara komersial [ 183]. Tikus yang diberi diet ketogenik KetoCal mengalami peningkatan kadar β-hidroksibutirat dan peningkatan rata-rata kelangsungan hidup sekitar 5 hari dibandingkan dengan hewan yang dipelihara dengan diet standar karbohidrat tinggi saja. Interaksi sinergis dari diet KD plus radiasi terlihat, karena tidak ada sinyal bioluminescent yang terdeteksi pada 9 dari 11 yang menerima pengobatan kombinasi. Selanjutnya, tidak ada tanda-tanda kekambuhan tumor yang terlihat selama lebih dari 200 hari ketika tikus yang diobati dialihkan ke SD 101 hari setelah implantasi tumor. Temuan ini menunjukkan resolusi tumor pada beberapa tikus yang diobati dengan terapi kombinasi. Dalam contoh ini, KD adalah tekanan dan radioterapi adalah denyut nadi. Penting untuk dikenali, bagaimanapun,31 , 251 – 253 ].
Diet ketogenik yang digunakan dengan terapi oksigen hiperbarik
Poff dan rekan menunjukkan bahwa terapi oksigen hiperbarik (HBOT) meningkatkan kemampuan KD untuk mengurangi pertumbuhan tumor dan metastasis [ 40 ]. Bukti pada model hewan dan manusia menunjukkan bahwa HBOT mungkin memiliki efek anti-kanker sederhana bila digunakan sendiri [ 254 ], tetapi tampak paling manjur bila digunakan dalam kombinasi dengan perawatan standar. Memang, HBOT telah terbukti efektif bila digunakan sebelum terapi radiasi untuk GBM [ 255 ]. Mekanisme HBOT dalam manajemen tumor belum jelas, tetapi menjenuhkan tumor dengan oksigen dapat membalikkan hipoksia dan menekan pertumbuhan [ 254 , 256 ] HBOT juga meningkatkan stres oksidatif dan peroksidasi lipid membran sel GBM in vitro [ 257]. Efek dari KD dan HBOT dapat ditingkatkan dengan pemberian keton eksogen, yang selanjutnya menekan pertumbuhan tumor dan metastasis [ 190 ]. Selain HBOT, vitamin C intravena dan dikloroasetat (DCA) juga dapat digunakan dengan KD untuk meningkatkan stres oksidatif secara selektif pada sel tumor [ 258 , 259 ]. Bukti terbaru juga menunjukkan bahwa suplementasi keton dapat meningkatkan atau menjaga kesehatan fisik dan mental secara keseluruhan [ 260 , 261], yang sering dikompromikan karena perkembangan penyakit dan standar terapi perawatan. Pada kondisi tersebut KD dengan exogenous keton berfungsi sebagai press, sedangkan HBOT berfungsi sebagai pulse. Meskipun HBOT dan radioterapi membunuh sel tumor melalui stres oksidatif, HBOT kurang toksik terhadap sel normal dibandingkan radioterapi.
Pembatasan kalori digunakan dengan penargetan glutamin untuk kanker metastatik
Beberapa tumor menggunakan glukosa sebagai bahan bakar utama untuk pertumbuhan, sedangkan tumor lainnya menggunakan glutamin sebagai bahan bakar utama [ 102 , 186 , 262 – 264 ]. Tumor yang bergantung pada glutamin umumnya kurang terdeteksi daripada yang bergantung pada glukosa di bawah pencitraan FDG-PET, tetapi dapat dideteksi di bawah pencitraan PET berbasis glutamin [ 265 ]. Penargetan glutamin harus memiliki manfaat terapeutik terhadap tumor yang bergantung pada glutamin untuk pertumbuhan dan kelangsungan hidup. Kami menemukan bahwa sel tumor VM-M3 yang bermetastasis sangat tergantung terutama pada ketersediaan glutamin untuk pertumbuhan dan kemampuan untuk menyebar secara sistemik [ 108]. Inhibitor glutaminase DON (6-diazo-5-oxo-L-norleucine) telah menunjukkan manfaat terapeutik di klinik, selama toksisitas dapat dikelola [186 , 266 ] . DON dapat bekerja paling baik jika dikombinasikan dengan penghambat glikolisis seperti lonidamin [ 186 ]. Selain DON, penghambat glutamin lainnya ((bis-2-(5-phenylacetamido-1,2, 4-thiadiazol-2-yl)ethyl sulfide, BPTES, atau CB-839) juga dapat menjadi terapi dalam penargetan yang bergantung pada glutamin tumor [ 267 ] Perhatian yang lebih besar terhadap kemungkinan efek samping akan diperlukan untuk penargetan glutamin daripada penargetan glukosa, karena glutamin terlibat dengan beberapa fungsi fisiologis penting terutama untuk sel-sel sistem kekebalan [ 268 , 269 ] .]. Oleh karena itu mungkin perlu juga menjadwalkan suplementasi glutamin secara berkala dengan penargetan glutamin untuk mendapatkan manfaat terapeutik maksimal sekaligus melindungi fungsi sistem kekebalan tubuh.
Tumor VM-M3 adalah sistem model yang sangat baik untuk mengevaluasi peran glutamin sebagai penggerak metabolisme kanker invasif dan metastatik. Tumor VM-M3 muncul secara spontan di otak inang tikus inbrida VM/Dk imunokompeten sinenetiknya [ 270 ]. Tumor diklasifikasikan sebagai glioblastoma ( GBM ) berdasarkan penampilan histologis, perilaku pertumbuhan invasif di otak, dan metastasis sistemik ketika memberikan akses ke situs ekstraneural [ 271-277 ] . Sel tumor VM-M3 neoplastik berbagi beberapa karakteristik dengan mikroglia/makrofag mesenkimal, yang melimpah di GBM dan menggunakan glutamin sebagai bahan bakar utama [ 278 , 279]. Meskipun pembatasan kalori sebagian dapat mengurangi invasi distal sel tumor VM-M3 di otak dan mengurangi pertumbuhan tumor primer di panggul, CR tidak mencegah metastasis sistemik meskipun menyebabkan penurunan glukosa darah dan peningkatan badan keton [108 , 280 ] . Namun, DON memiliki efek besar dalam mengurangi ukuran tumor primer dan metastasis sistemik yang menunjukkan pentingnya glutamin dalam menggerakkan tumor ini [ 108 ]. Interaksi sinergis juga terlihat ketika DON dikombinasikan dengan pembatasan kalori [ 281]. Modifikasi penjadwalan, waktu, dan dosis DON akan diperlukan untuk meningkatkan kemanjuran dan mengurangi toksisitas. Dalam contoh ini, CR adalah tekanan dan DON adalah denyut nadi. Karena glutamin adalah bahan bakar utama sel kekebalan, penargetan glutamin harus efektif dalam mengurangi sebagian besar kanker metastatik yang memiliki karakteristik makrofag dan sel kekebalan lainnya [ 121 ].
Optimalisasi penjadwalan, waktu, dan dosis
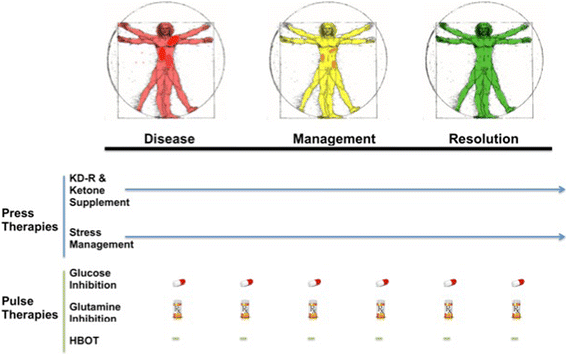
Keberhasilan strategi terapi tekanan-denyut untuk pengelolaan metabolisme kanker akan tergantung pada optimalisasi penjadwalan, dosis, dan waktu dari berbagai diet, obat-obatan, dan prosedur yang digunakan untuk mencapai interaksi sinergis yang maksimal (Gbr. 2). Penjadwalan akan melibatkan urutan pulsa yang dipilih dikirim ke subjek saat menjalani terapi diet. Pengaturan waktu akan menentukan kapan dan berapa lama tekanan dan pulsa diberikan (angka/hari,/minggu,/bulan dll.). Dosis akan mengidentifikasi dosis obat optimal yang diperlukan untuk membunuh sel tumor sambil mencegah atau meminimalkan toksisitas sistemik. Penjadwalan untuk masing-masing variabel tersebut dapat disesuaikan dengan usia, jenis kelamin, dan status kesehatan subjek secara umum. Strategi tersebut harus menurunkan populasi sel tumor secara bertahap untuk mencegah sindrom lisis tumor, yang dapat menyebabkan toksisitas yang berlebihan. Prosedur pencitraan tumor yang melibatkan FDG-PET, magnetic resonance imaging (MRI), dan computed tomography perfusion (CTP), serta analisis biomarker kanker serum harus membantu dalam menilai keberhasilan terapi.
Ilustrasi Strategi Terapi Tekan-Denyut untuk Manajemen Kanker. Strategi terapeutik "Press-Pulse" menganggap kanker sebagai penyakit sistemik tunggal terlepas dari jaringan spesifik atau sistem organ yang mengandung sel tumor invasif atau metastatik. Strategi ini dirancang untuk menargetkan ketergantungan glukosa dan glutamin pada sel tumor, sekaligus meningkatkan efisiensi metabolisme pada sel normal. Terapi pers dirancang untuk mengurangi ketersediaan glukosa sistemik sambil meningkatkan kadar badan keton dalam darah, yang tidak dapat digunakan sel tumor secara efektif untuk menghasilkan energi. Pendekatan ini mengadu kebutuhan metabolisme sel normal dengan sel tumor yang bermutasi, yang kurang mampu dibandingkan sel normal dalam beradaptasi dengan stres metabolik akibat kekurangan nutrisi. Suplemen tubuh keton selanjutnya dapat mengurangi kadar glukosa sekaligus meningkatkan metabolisme energi pernapasan dalam sel normal. Teknik manajemen stres bersama dengan olahraga dapat semakin menekan metabolisme sel tumor sambil meningkatkan kesehatan secara umum. Terapi pers akan dirancang untuk bekerja secara sinergis dengan terapi denyut akut untuk lebih menargetkan metabolisme glukosa dan glutamin. HBOT akan bekerja sama dengan terapi pers untuk secara selektif meningkatkan stres oksidatif pada sel tumor. Jarak antara berbagai terapi denyut dirancang untuk menekankan metabolisme sel tumor sambil meminimalkan toksisitas pada sel tubuh normal. Strategi terapeutik ini akan menargetkan metabolisme fermentasi yang umum terjadi pada sebagian besar sel tumor, sehingga secara bertahap menurunkan beban tumor. Perubahan warna progresif pada pria Vitruvian yang tergambar dari merah (sakit dengan bintik-bintik merah gelap yang mengindikasikan lesi metastatik), menjadi kuning (berkurangnya metastasis), menjadi hijau (resolusi) melambangkan manajemen metabolisme bertahap dan resolusi kanker. Simbol pil menunjukkan penargetan glikolisis yang dapat diberikan secara oral. Simbol Rx menunjukkan penargetan glutamin yang dapat diberikan secara intravena. Terapi denyut akan berakhir dengan bukti penatalaksanaan atau resolusi sementara terapi tekan dapat berlanjut dengan modifikasi atau penyesuaian ( Simbol Rx menunjukkan penargetan glutamin yang dapat diberikan secara intravena. Terapi denyut akan berakhir dengan bukti penatalaksanaan atau resolusi sementara terapi tekan dapat berlanjut dengan modifikasi atau penyesuaian ( Simbol Rx menunjukkan penargetan glutamin yang dapat diberikan secara intravena. Terapi denyut akan berakhir dengan bukti penatalaksanaan atau resolusi sementara terapi tekan dapat berlanjut dengan modifikasi atau penyesuaian (panah ). Optimalisasi dosis, waktu, dan penjadwalan strategi terapi tekan-pulsa akan memfasilitasi pemberantasan sel tumor dengan toksisitas pasien yang minimal. Strategi terapeutik ini dapat digunakan sebagai kerangka kerja untuk desain uji klinis untuk sebagian besar kanker. HBOT, terapi oksigen hiperbarik; KD-R, diet ketogenik terbatas kalori
Diskusi & Kesimpulan
Banyak pengobatan saat ini yang digunakan untuk manajemen kanker didasarkan pada pandangan bahwa kanker adalah penyakit genetik. Jelas dari statistik kematian akibat kanker bahwa sebagian besar terapi saat ini menginginkan kemampuan mereka untuk mengurangi tingkat kematian tahunan atau untuk mengelola penyakit tanpa toksisitas. Bukti yang muncul menunjukkan bahwa kanker adalah penyakit metabolisme mitokondria yang bergantung pada ketersediaan bahan bakar yang dapat difermentasi untuk pertumbuhan dan kelangsungan hidup sel tumor. Glukosa dan glutamin adalah bahan bakar terfermentasi paling melimpah yang ada di sirkulasi dan di lingkungan mikro tumor. Strategi terapi tekan-pulsa dirancang untuk menargetkan ketersediaan glukosa dan glutamin sehingga membuat sel tumor kelaparan akan bahan bakar terpentingnya dan meningkatkan kerentanannya terhadap stres oksidatif dan kematian apoptosis. Rendah karbohidrat, diet tinggi lemak-ketogenik ditambah dengan penghambat glikolisis akan mengurangi fluks metabolisme melalui jalur glikolitik dan pentosa fosfat yang diperlukan untuk sintesis ATP, lipid, glutathione, dan nukleotida. DON dan penghambat glutamin serupa lainnya akan menghilangkan sel tumor yang berkembang biak dari glutamin yang dibutuhkan untuk anaplerosis siklus TCA, dan sintesis glutathione, nukleotida, dan protein. Penargetan lisosom dengan klorokuin atau obat serupa akan mengurangi produksi glukosa dan glutamin setelah pencernaan glikokonjugat dan protein yang difagositosis. Namun, penargetan glutamin akan membutuhkan penyesuaian yang hati-hati, karena glutamin adalah metabolit utama yang diperlukan untuk sistem kekebalan dan untuk fungsi fisiologis lainnya. Terapi oksigen hiperbarik yang dikombinasikan dengan diet ketogenik yang dibatasi kalori akan membunuh sel tumor melalui mekanisme apoptosis dan anti-angiogenik sekaligus mengurangi peradangan di lingkungan mikro tumor dan secara sistemik. Ini adalah pandangan kami bahwa paradigma "Press-Pulse" adalah strategi terapeutik yang menarik dan pelit untuk secara efektif mengelola sebagian besar kanker ganas dengan toksisitas minimal, karena pendekatan ini akan menargetkan jalur energi utama yang bertanggung jawab untuk pertumbuhan dan kelangsungan hidup sel tumor sambil meningkatkan efisiensi energi sel dan jaringan tubuh normal.
Singkatan
- 2-DG:
2-deoksiglukosa
- CR:
Pembatasan kalori
- MENGENAKAN:
6-diazo-5-oxo- L -norleucine
- MODE:
Flavin adenin dinukleotida
- GBM:
Glioblastoma multiforme
- GKI:
Indeks Glukosa Keton
- HBOT:
Terapi oksigen hiperbarik
- KD-R:
Diet Ketogenik Terbatas
- NAD:
nikotinamid adenin dinukleotida
- ROS:
Spesies Oksigen Reaktif
- SLP:
Fosforilasi tingkat substrat
- TCA:
Asam trikarboksilat
Sumber:
https://nutritionandmetabolism.biomedcentral.com/articles/10.1186/s12986-017-0178-2
Kutip artikel ini
Seyfried, TN, Yu, G., Maroon, JC dkk. Press-pulse: strategi terapi baru untuk manajemen metabolisme kanker. Nutr Metab (Lond) 14 , 19 (2017). https://doi.org/10.1186/s12986-017-0178-2
Diterima
Diterima
Diterbitkan
DOIhttps://doi.org/10.1186/s12986-017-0178-2
Kata kunci
- Glukosa
- Glutamin
- Mitokondria
- Badan keton
- Diet
- efek Warburg
- Metabolisme kanker
- Glutaminolisis
- oksigen hiperbarik

Tidak ada komentar:
Posting Komentar