Fermentasi aerobik: penyakit metabolisme sel tumor yang umum
Sebagian besar sel tubuh mengoksidasi glukosa menjadi CO 2 dan air untuk produksi energi. Sebelum memasuki mitokondria untuk oksidasi sempurna, glukosa terlebih dahulu dipecah menjadi dua molekul piruvat melalui jalur glikolitik Embden–Meyerhof–Parnas di sitosol. Karena sebagian besar sel bermandikan oksigen, produksi piruvat terjadi melalui glikolisis aerobik [ 34 ]. Namun, di bawah hipoksia, banyak piruvat direduksi menjadi asam laktat untuk mempertahankan produksi ATP sel. Fermentasi aerobik, di sisi lain, melibatkan produksi asam laktat dalam kondisi normoksik. Karena efek Pasteur akan mengurangi fermentasi asam laktat di bawah normoksia, produksi asam laktat yang terus-menerus dengan adanya oksigen yang cukup merupakan indikasi respirasi abnormal [ 35]. Otto Warburg pertama kali mengusulkan bahwa semua kanker muncul dari kerusakan respirasi seluler. Akibatnya, sel kanker meningkatkan kapasitasnya untuk menghasilkan asam laktat bahkan dengan adanya oksigen untuk mengkompensasi kekurangan respirasi [ 31 , 36 ].
Meskipun hipotesis Warburg tentang asal usul kanker telah menimbulkan kebingungan dan kontroversi [ 37-40 ] , hipotesisnya tidak pernah dibantah. Efek Crabtree dan tingkat konsumsi oksigen yang tinggi yang terlihat pada beberapa sel tumor telah mengacaukan gambaran fosforilasi oksidatif yang rusak pada sel tumor. Efek Crabtree adalah artefak dari lingkungan in vitro dan melibatkan supresi respirasi yang diinduksi glukosa dengan peningkatan produksi asam laktat yang sesuai bahkan di bawah kondisi hiperoksik (pO2 = 120-160 mmHg) yang terkait dengan kultur sel, [ 41 , 42]. Juga, konsumsi oksigen yang terlihat pada sel tumor tidak selalu terkait dengan produksi ATP melalui fosforilasi oksidatif dan karenanya tidak dapat digunakan sendiri sebagai bukti respirasi normal [ 29 , 43-48 ] . Sulit untuk secara akurat mengukur fungsi pernapasan mitokondria dalam sel yang dibiakkan kecuali kontrol yang tepat digunakan, karena lingkungan in vitro dapat mengubah fungsi mitokondria [ 41 , 49 ]. Isu-isu ini telah mengacaukan interpretasi temuan Warburg meskipun upayanya untuk mengklarifikasi isu [ 32 , 48 , 50]. Namun demikian, teori Warburg tentang respirasi aerobik yang tidak mencukupi tetap menjadi penjelasan yang paling dapat dipercaya untuk asal sel tumor [ 2 , 37 , 51-57 ].
Pokok-pokok teori Warburg adalah; 1) respirasi yang tidak mencukupi adalah inisiator predisposisi tumorigenesis dan akhirnya kanker, 2) energi melalui glikolisis secara bertahap mengkompensasi kekurangan energi melalui respirasi, 3) sel kanker terus memproduksi asam laktat dengan adanya oksigen, dan 4) insufisiensi pernapasan akhirnya menjadi tidak dapat diubah. [ 2 , 31 , 32 , 36 , 58 , 59 ]. Warburg menyebut fenomena peningkatan glikolisis dalam sel kanker sebagai "fermentasi aerobik" untuk menyoroti produksi abnormal asam laktat dengan adanya oksigen [ 31 , 32 , 36 , 58, 59 ]. Efraim Racker menciptakan istilah "efek Warburg", yang mengacu pada glikolisis aerobik yang terjadi pada sel kanker [ 60 ]. Meskipun Warburg bersikeras bahwa glikolisis aerobik mengacaukan masalah respirasi yang tidak mencukupi sebagai asal mula kanker [ 31 , 32 ], beberapa bidang metabolisme kanker tetap berpikir bahwa glikolisis aerobik (efek Warburg) adalah masalah sentral dalam metabolisme kanker [ 39 , 61 ]. Warburg dengan jelas mendemonstrasikan bahwa fermentasi aerobik (glikolisis aerobik) adalah efek, dan bukan penyebab, dari kekurangan respirasi [ 36 ]. Oleh karena itu, penargetan bahan bakar yang dapat difermentasi menjadi sangat penting untuk manajemen kanker.
Bukti substansial ada yang menunjukkan bahwa banyak kanker rajin mengkonsumsi glukosa dan menghasilkan asam laktat [ 62-67 ]. Prosedur diagnostik tomografi emisi positron 18 F-deoxyglucose positron (FDG-PET) dianggap sebagai bukti peningkatan penggunaan glukosa oleh beberapa tumor [ 66 ]. Konsumsi glukosa yang meningkat akan diharapkan untuk setiap sel yang bergantung pada glukosa dengan kelainan kuantitatif atau kualitatif di mitokondria, karena peningkatan fermentasi akan diperlukan untuk mengkompensasi kekurangan respirasi [ 43 , 68]. Memang, semua sel tumor yang telah diperiksa hingga saat ini mengandung kelainan pada kandungan atau komposisi kardiolipin, lipid khas dari membran mitokondria bagian dalam yang mengatur fosforilasi oksidatif [ 69-74 ] . Sel mamalia yang mengandung kelainan kardiolipin tidak dapat bernafas secara efektif dan oleh karena itu perlu meningkatkan produksi energi melalui reaksi fermentasi [ 41 , 70 , 73 , 75-78 ]. Fakta ini tidak dapat terlalu ditekankan mengingat argumen bahwa sel tumor dapat memiliki respirasi normal [ 39 , 61 , 79]. Ekspresi kardiolipin yang belum matang terkait dengan aktivitas Kompleks I yang berkurang di membran mitokondria bagian dalam sel tumorigenik dan non-tumorigenik menunjukkan bahwa banyak sel proliferatif yang tumbuh dalam kultur mendapatkan energi melalui fermentasi daripada melalui fosforilasi oksidatif meskipun konsumsi oksigen normal [ 41 , 43 ]. Abnormalitas kardiolipin yang ditemukan pada sel tumor memberikan dukungan langsung untuk teori sentral Warburg. Selain abnormalitas kardiolipin, Pedersen juga menunjukkan bahwa beberapa derajat abnormalitas dapat ditemukan pada jumlah, struktur, atau fungsi mitokondria sel tumor yang memberikan dukungan lebih lanjut untuk teori Warburg [ 68]. Bukti yang mendukung teori asli Warburg berasal dari berbagai jenis kanker dan sekarang sangat banyak [ 2 , 36 , 53 , 80-85 ] . Oleh karena itu, insufisiensi pernapasan, yang timbul dari sejumlah cacat mitokondria, dapat berkontribusi pada metabolisme fermentasi yang terlihat pada sel tumor.
Meskipun metabolisme energi abnormal dan kelainan mitokondria yang terlihat pada kebanyakan kanker dapat muncul sebagian melalui modulasi metabolisme onkogenik [ 4 , 39 , 86 ], data dari percobaan transfer nuklir dan mitokondria menunjukkan bahwa perubahan onkogen adalah efek, bukan penyebab, dari tumorigenesis [ 2 , 14 , 24 , 87 , 88 ]. Mitokondria normal dapat menekan tumorigenesis, sedangkan mitokondria abnormal dapat meningkatkan tumorigenesis [ 14 , 87]. Hasil dari eksperimen ini harus dilihat bersama, karena hasil dari eksperimen tunggal mana pun tidak mampu menjungkirbalikkan teori gen [ 14 ]. Kemajuan terbaru dalam teknologi CRISPR/Cas9 dapat membantu menghasilkan nuklei dengan perubahan pada gen terkait tumor spesifik untuk mengevaluasi lebih lanjut pengaruh mutasi gen dan fungsi mitokondria pada tumorigenesis. Akuisisi mitokondria disfungsional dalam makrofag melalui hibridisasi fusi dengan sel tumor non-metastatik memberikan argumen yang kuat untuk asal sel kanker yang menjadi metastatik [ 5 , 89-91]. Kami baru-baru ini menunjukkan bagaimana semua tanda kanker Hanahan & Weinberg, termasuk mutasi genomik, dapat dikaitkan baik secara langsung maupun tidak langsung dengan disfungsi mitokondria [ 2 , 56 , 92 ].
Fermentasi asam amino juga bisa mendorong metabolisme kanker
Sebagai hasil dari respirasi aerobik yang tidak mencukupi, sel kanker harus bergantung terutama pada metabolisme fermentasi untuk menjaga keseimbangan energi dan kelangsungan hidup. Selain fosforilasi tingkat substrat dalam sitoplasma melalui fermentasi asam laktat, fosforilasi tingkat substrat siklus TCA juga dapat menghasilkan ATP dalam jumlah yang signifikan [ 93-98 ] . Selain glukosa, sel kanker juga sangat bergantung pada glutamin untuk pertumbuhan dan kelangsungan hidup [ 99 – 102]. Glutamin bersifat anapleurotik dan dapat dengan cepat dimetabolisme menjadi glutamat dan kemudian menjadi α-ketoglutarat untuk masuk ke dalam siklus TCA. Selain berfungsi sebagai sumber karbon/nitrogen untuk pertumbuhan sel tumor, glutamin juga berperan dalam kelangsungan hidup dan pertumbuhan sel kanker melalui pelepasan amonia secara enzimatik ke lingkungan mikro [ 103 ]. Reaksi thiokinase suksinat siklus TCA dapat menghasilkan sebagian besar ATP seluler melalui fosforilasi tingkat substrat di bawah hipoksia atau dalam sel tumor dengan fosforilasi oksidatif yang rusak [ 78]. Produksi ATP mitokondria melalui fosforilasi tingkat substrat siklus TCA, menggunakan glutamin sebagai substrat, dapat memberikan kesan bahwa metabolisme energi mitokondria normal pada beberapa sel kanker terutama dalam kombinasi dengan konsumsi oksigen dan produksi CO2 . Meskipun Warburg tidak membahas peran fosforilasi tingkat substrat siklus TCA dalam karya aslinya [ 31 , 36 ], peningkatan fosforilasi tingkat substrat siklus TCA akan diharapkan dalam sel dengan defisiensi OxPhos, seperti fermentasi asam laktat diharapkan dalam sel dengan kekurangan ini. Studi lebih lanjut akan diperlukan untuk membuktikan peran fermentasi glutamin dalam sel kanker.
Glukosa dan glutamin bekerja secara sinergis untuk mendorong pertumbuhan sel tumor yang cepat. Metabolisme glutamin dapat menghasilkan ATP dari siklus TCA dalam kondisi aerobik. Glutamin juga merupakan donor nitrogen untuk biosintesis nukleotida dan dapat berfungsi sebagai prekursor untuk sintesis lipid dalam kondisi hipoksia [ 104 , 105 ]. Kami juga menemukan bahwa hanya sejumlah kecil glutamin yang dimetabolisme menjadi asam laktat di bawah normoksia atau hipoksia pada sel glioblastoma invasif VM-M3 yang konsisten dengan temuan pada sel tumor lainnya [ 105 – 107]. Kami menyarankan bahwa metabolisme glukosa dan glutamin untuk energi akan bergantung pada keadaan fisiologis lingkungan mikro tumor, dan akan lebih penting pada tumor dengan fenotipe Warburg yang agresif. Kami menemukan bahwa penargetan glutamin dapat efektif dalam mengelola kanker metastatik sistemik pada tikus VM/Dk [ 108 ].
Fermentasi asam amino dapat menghasilkan energi melalui fosforilasi tingkat substrat siklus TCA dalam kondisi hipoksia [ 94 , 96 , 97 , 109 , 110 ]. Suksinat adalah produk limbah fermentasi asam amino yang dapat meningkatkan peradangan serta menghambat keluarga hidroksilase prolyl, yang memfasilitasi degradasi Hif-1α melalui produk gen von Hippel-Lindau (VHL) [ 111-113 ] . Melalui aksinya pada beberapa jalur glikolitik, stabilisasi Hif-1α meningkatkan fermentasi aerobik [ 114 – 116]. Ini bisa sulit untuk menentukan, bagaimanapun, sejauh mana produksi ATP mitokondria dalam sel tumor muncul dari respirasi digabungkan atau dari fosforilasi tingkat substrat siklus TCA [ 94 , 98 ].
Beberapa produk sampingan dari fermentasi asam amino juga dapat terakumulasi dalam lingkungan mikro tumor termasuk asetat, glutamat, alanin, suksinat, dan amonia. Meskipun asetat telah dianggap sebagai bahan bakar potensial untuk mendukung pertumbuhan sel tumor [ 117 , 118 ], kadar asetat umumnya rendah dalam sirkulasi [ 119 ]. Jaworski et al. baru-baru ini memberikan diskusi komprehensif tentang potensi peran asetat dalam metabolisme tumor [ 120]. Harus diakui bahwa dengan pengecualian glukosa dan glutamin, tidak ada bahan bakar potensial lain yang diperlukan untuk fermentasi sel tumor yang mungkin tersedia dalam jumlah yang cukup untuk mendorong pertumbuhan sel tumor yang kuat. Karena banyak asam amino yang disintesis dari glukosa dan glutamin, penargetan glukosa dan glutamin akan menghilangkan lingkungan mikro dari bahan bakar yang dapat difermentasi. Oleh karena itu, pembatasan glukosa dan glutamin menjadi sangat penting untuk menargetkan pertumbuhan dan kelangsungan hidup sel tumor. Peran glukosa dan glutamin dalam mendorong metabolisme energi sel tumor ditunjukkan pada Gambar 1 .
Metabolit energi sel tumor dari kanibalisme dan fagositosis
Bukti yang muncul menunjukkan bahwa makrofag, atau hibridisasi fusinya dengan sel punca neoplastik, adalah asal dari sel kanker metastatik [ 5 , 89 , 121-124 ]. Terapi radiasi dapat meningkatkan hibridisasi fusi yang dapat meningkatkan risiko sel tumor invasif dan metastatik [ 91 , 125 ]. Kanibalisme dan fagositosis puing-puing seluler adalah karakteristik makrofag dan sel kanker myeloid yang terkenal dengan sifat makrofag [ 121 , 126 – 131]. Shelton menunjukkan bahwa sel glioblastoma dengan sifat myeloid dapat bertahan di Matrigel (materi matriks ekstraselular) tanpa tambahan glukosa dan glutamin [ 132 ]. Akumulasi laktat secara bertahap di media menunjukkan bahwa sel glioblastoma bertahan melalui pencernaan lisosom dan fermentasi aerobik glikokonjugat yang ada di Matrigel. Kematian sel glioblastoma terjadi segera setelah penambahan klorokuin, yang menetralkan keasaman lisosom dan pencernaan [ 132 ]. Temuan Shelton konsisten dengan temuan yang lebih baru dari Kamphorst et al. dalam menunjukkan bahwa sel-sel adenokarsinoma duktus pankreas dapat memperoleh glutamin dalam kondisi nutrisi yang buruk melalui pencernaan lisosom protein ekstraseluler [ 133]. Oleh karena itu, perlu juga menargetkan pencernaan lisosom, di bawah kondisi glukosa dan glutamin yang berkurang, untuk secara efektif mengelola kanker invasif dan metastatik yang mengekspresikan kanibalisme dan fagositosis.
Integritas genom dan metabolisme energi
Bukti yang muncul menunjukkan bahwa fungsi enzim perbaikan DNA dan integritas genom inti sangat tergantung pada energi yang berasal dari respirasi normal [ 134-142 ] . Studi sebelumnya pada sel ragi dan mamalia menunjukkan bahwa gangguan respirasi aerobik dapat menyebabkan mutasi (kehilangan heterozigositas, ketidakstabilan kromosom, dan modifikasi epigenetik, dll.) pada genom inti [28 , 141 , 143 , 144 ] . Ketergantungan yang berlarut-larut pada fermentasi menyebabkan stres oksidatif yang mengarah pada produksi spesies oksigen reaktif (ROS) sebagian besar melalui koenzim Q pasangan mitokondria [ 145]. Selain perannya dalam pensinyalan onkogenik, kelebihan produksi ROS merusak fungsi mitokondria, dan dapat bersifat karsinogenik dan mutagenik [ 146 , 147 ]. Mutasi somatik dan ketidakstabilan genom yang terlihat pada sel tumor muncul dari ketergantungan yang berlarut-larut pada metabolisme energi fermentasi dan gangguan keseimbangan redoks melalui stres oksidatif berlebih.
Kami baru-baru ini membahas bagaimana transisi dari respirasi ke fermentasi dapat menjelaskan “Paradoks Onkogenik” Szent-Gyorgi, yaitu proses di mana berbagai agen provokatif (radiasi, peradangan, hipoksia, bahan kimia karsinogenik, usia, mutasi germline, dll.) dapat menghasilkan kanker melalui mekanisme patologis umum [ 2 , 148 ]. Mukherjee dan Cairns juga berjuang untuk menjelaskan paradoks onkogenik [ 149 , 150]. Semua agen penyebab kanker yang provokatif ini merusak pernapasan sehingga memaksa sel untuk lebih mengandalkan energi yang dihasilkan melalui fermentasi untuk bertahan hidup. Menurut teori metabolisme mitokondria kanker, heterogenitas genom besar terlihat pada sel tumor muncul sebagai konsekuensi, bukan sebagai penyebab, disfungsi mitokondria [ 2 , 14 , 28 ]. Oleh karena itu, strategi terapeutik yang menargetkan kelainan metabolisme yang umum pada sebagian besar sel tumor harus lebih efektif dalam mengelola kanker daripada strategi yang menargetkan mutasi genetik yang sangat bervariasi antara tumor dengan tingkat histologis yang sama dan bahkan di dalam tumor yang sama.
Evolusi manusia dan keserbagunaan adaptif
Rick Potts, ahli paleoantropologi di Smithsonian Institution, menyatakan bahwa keberhasilan evolusi spesies kita sebagian besar disebabkan oleh pewarisan germline dari sifat-sifat yang memberikan keserbagunaan adaptif [ 151-153 ] . Adaptasi didefinisikan dalam hal, 1) kemampuan suatu organisme untuk bertahan melalui perubahan lingkungan yang besar, 2) untuk menyebar ke habitat baru, dan 3) untuk merespon dengan cara baru terhadap lingkungannya [ 153]. Karakteristik ini diasah selama jutaan tahun dan memungkinkan manusia beradaptasi dengan cepat terhadap perubahan mendadak dalam lingkungan fisik termasuk perubahan kelembapan, suhu, sumber makanan, dll. Kemampuan beradaptasi terhadap perubahan lingkungan yang mendadak adalah sifat genom, yang dipilih secara berurutan untuk memastikan kelangsungan hidup di bawah ekstrem lingkungan [ 65 , 154 ].
Hipotesis Potts merupakan perluasan dari teori asli Darwin (Bab IV, Seleksi Alam) dan dapat diterapkan pada sel-sel individu organisme, yang ada sebagai masyarakat sel yang terintegrasi [ 65 , 154 ]. Oleh karena itu, keberhasilan dalam mengatasi tekanan lingkungan dan penyakit bergantung pada tindakan terpadu dari semua sel dalam organisme. Selanjutnya, tindakan terpadu ini bergantung pada fleksibilitas genom setiap sel, yang merespons sinyal internal dan eksternal sesuai dengan kebutuhan organisme. Lebih khusus lagi, hanya sel-sel yang memiliki fleksibilitas dalam pemanfaatan nutrisi yang akan mampu bertahan di bawah tekanan nutrisi. Oleh karena itu pemaksaan lingkungan telah memilih genom yang paling mampu beradaptasi terhadap perubahan untuk mempertahankan homeostasis metabolik.65 , 152 , 153 , 155 ]. Konsep ini pertama kali dibahas dalam kaitannya dengan pengelolaan kanker otak [ 65 ].
Gagasan yang dipegang secara luas bahwa sel-sel tumor memiliki keunggulan pertumbuhan dan lebih bugar daripada sel-sel normal bertentangan dengan teori evolusi Darwin dan juga teori fleksibilitas adaptif Potts [65 , 153 , 154 ] . Sulit membayangkan bagaimana akumulasi acak dari mutasi somatik dapat meningkatkan kemampuan beradaptasi dan kebugaran sel kanker. Penting untuk diketahui bahwa mutasi pada p53 , K-Ras , dan Raf berdampak negatif pada efisiensi energi mitokondria sehingga membuat sel dengan mutasi ini kurang fleksibel secara metabolik daripada sel normal [ 28 , 44 , 53 , 135 , 156– 159 ]. Memang mengaktifkan mutasi pada mitokondria target K-Ras , sehingga meningkatkan glikolisis [ 53 , 160 ]. Glikolisis yang ditingkatkan akan membuat sel tumor tampak lebih sehat secara metabolik daripada sel normal di lingkungan hipoksia [ 161 , 162 ]. Sebagian besar sel normal, bagaimanapun, tidak dapat tumbuh dalam kondisi hipoksia dan akan sering mati dalam lingkungan hipoksia akibat gagal napas. Sel tumor lebih cocok daripada sel normal untuk bertahan hidup di relung hipoksia dari lingkungan mikro tumor. Adaptasi hipoksia sel tumor memungkinkan mereka untuk menghindari apoptosis karena pemrograman ulang metaboliknya setelah hilangnya fungsi pernapasan secara bertahap [ 31 , 32 , 162, 163 ]. Tingginya tingkat glikolisis sel tumor dan glutaminolisis juga akan membuat mereka resisten terhadap obat apoptosis, ROS, dan kemoterapi [ 163 ]. Meskipun memiliki kadar ROS yang tinggi, glutamat yang berasal dari glutamin berkontribusi pada produksi glutathione yang dapat melindungi sel tumor dari ROS [ 164 ]. Selama sel-sel tumor memiliki akses ke bahan bakar metabolik yang dibutuhkan untuk glikolisis dan fosforilasi tingkat substrat siklus TCA (glukosa dan glutamin, masing-masing), mereka akan tampak memiliki keunggulan pertumbuhan dibandingkan kebanyakan sel normal .]. Menurut Darwin dan Potts, mutasi yang memberikan keunggulan selektif adalah mutasi yang akan meningkatkan kelangsungan hidup di bawah tekanan lingkungan. Jika beberapa mutasi titik patogenik, penataan ulang kromosom, dan kelainan mitokondria memberikan keuntungan kebugaran atau kelangsungan hidup sel tumor, maka kelangsungan hidup di bawah tekanan lingkungan dan kekurangan gizi harus lebih baik dalam sel tumor daripada sel normal [165 ] . Namun, ini bukanlah yang sebenarnya terjadi ketika hipotesis diuji.
Misalnya, ketika tikus atau orang dengan tumor ditempatkan di bawah tekanan energi menggunakan diet pengurangan energi (pembatasan glukosa), banyak sel tumor mati sementara sel normal bertahan hidup. Memang, kesehatan dan vitalitas sel-sel normal meningkat dengan waktu di bawah pengurangan energi diet sementara sel tumor hiper-glikolitik mengalami krisis energi yang memicu kematian apoptosis [ 166 , 167 ]. Pendukung pendapat ini berasal dari penelitian pengobatan tumor otak dengan stres energi makanan [ 114 , 168 – 174]. Jelas bahwa kemampuan beradaptasi terhadap tekanan lingkungan lebih besar pada sel normal daripada sel tumor, karena sel normal dapat beralih dari metabolisme glukosa ke metabolisme badan keton ketika glukosa menjadi terbatas. Fosforilasi oksidatif mitokondria kurang kuat dalam sel tumor daripada sel normal sementara pemanfaatan glukosa melalui fermentasi asam laktat lebih besar pada sel tumor daripada sel normal. Oleh karena itu, menargetkan ketersediaan glukosa akan menyebabkan kematian yang lebih besar pada sel tumor daripada pada sel normal. Cacat rantai pernapasan mitokondria akan mencegah sel tumor menggunakan badan keton untuk energi [ 145]. Akibatnya, sel tumor yang bergantung pada glikolisis kurang dapat beradaptasi dengan stres metabolik daripada sel normal. Kerentanan ini dapat dimanfaatkan untuk menargetkan metabolisme energi sel tumor [ 160 , 163 ].
Hal ini juga memungkinkan bahwa stres energi terapeutik dapat memulihkan lingkungan mikro sehingga membalikkan metabolisme energi abnormal dan perilaku pertumbuhan sel tumor yang tidak mengandung mutasi genetik [ 19 , 175 ]. Berbeda dengan pengurangan energi makanan, radiasi dan obat-obatan beracun dapat merusak lingkungan mikro dan mengubah sel normal menjadi sel tumor sekaligus menciptakan sel tumor yang menjadi sangat resisten terhadap obat dan radiasi. Sel-sel tumor yang resistan terhadap obat muncul sebagian besar dari kerusakan pernapasan pada sel-sel pra-kanker pengamat. Sel-sel ini sering kali menjadi sangat bergantung pada fermentasi untuk energi.
Adaptasi sel normal yang lebih besar daripada sel tumor terhadap tekanan energi diperkirakan berdasarkan teori Darwin dan Potts [ 154 ]. Fleksibilitas metabolik memungkinkan organisme untuk merespons secara terkoordinasi terhadap tekanan lingkungan dan ketersediaan substrat yang terbatas. Stres energi akan memaksa semua sel normal bekerja sama untuk kelangsungan hidup organisme [ 154 ]. Mutasi patogen dan ketidakstabilan genom akan mengurangi kemampuan beradaptasi dan fleksibilitas metabolisme di bawah tekanan energi. Semakin besar ketidakstabilan genom dalam sel tumor, semakin sedikit kemampuan beradaptasi mereka terhadap stres. Konsep ini mirip dengan konsep Nowell kecuali dalam melihat ketidakstabilan genomik sebagai sebuah kewajiban daripada sebagai keuntungan untuk perkembangan [ 154 , 176]. Karena energi yang dihasilkan melalui fosforilasi tingkat substrat lebih besar pada sel tumor daripada sel normal, sel tumor lebih tergantung daripada sel normal pada ketersediaan bahan bakar yang dapat difermentasi (glukosa dan glutamin) [ 94 ]. Dengan sedikit pengecualian, sebagian besar sel normal mengubah metabolisme energi dari glukosa menjadi badan keton dan lemak ketika ditempatkan di bawah tekanan energi akibat kekurangan glukosa, defisiensi insulin, dan puasa berkepanjangan. Pergeseran ini adalah hasil dari keserbagunaan adaptif dan stabilitas genomik, yang kurang pada sel tumor tetapi menonjol pada sel dan jaringan dengan fungsi mitokondria yang kuat.
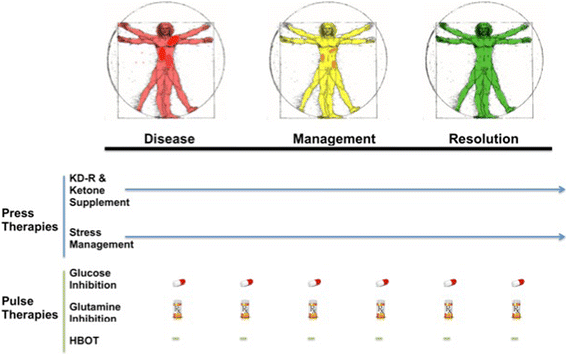
Sel-sel tumor akan mengalami kesulitan untuk bertahan hidup dan tumbuh, terlepas dari komplemen perubahan genomiknya, jika bahan bakar yang dapat difermentasi dibatasi dalam lingkungan mikro. Badan keton dan lemak adalah bahan bakar yang tidak dapat difermentasi [ 177 ]. Sel tumor mengalami kesulitan menggunakan badan keton dan lemak sebagai bahan bakar ketika glukosa berkurang [ 57 , 178 – 180 ]. Meskipun beberapa sel tumor mungkin tampak mengoksidasi badan keton dengan adanya enzim ketolitik [ 181], tidak jelas apakah badan keton dan lemak dapat memberikan energi yang cukup untuk kelangsungan hidup sel tanpa adanya glukosa dan glutamin. Studi pada tikus syngeneic immunocompetent dan xenografts dengan tumor otak adalah bukti konsep bahwa sel tumor kurang beradaptasi dibandingkan sel normal ketika ditempatkan di bawah tekanan energi [ 114 , 170 , 171 , 182-184 ] . Apoptosis di bawah tekanan energi lebih besar pada sel tumor daripada sel normal [ 170]. Cacat genetik ganda pada sel tumor akan mengurangi fleksibilitas genom sehingga meningkatkan kemungkinan kematian sel di bawah tekanan lingkungan yang akan menurunkan glukosa dan meningkatkan badan keton. Terlepas dari kapan atau bagaimana cacat genom terlibat dalam inisiasi atau perkembangan tumor, cacat ini dapat dimanfaatkan untuk manajemen tumor atau resolusi [ 12 ].




.png)




.png)
.png)
.png)